研究背景:荧光素二乙酸酯(FDA)是一种细胞膜可渗透的酯酶底物,被广泛用于评估细胞活力。活细胞中的酯酶催化二乙酸酯的水解产生绿色荧光素。由于FDA荧光与活性氧(ROS)水平呈正相关,它也被用于评估细胞的ROS水平。碘化丙啶(PI)是一种核酸染料,可与核酸结合激发红色荧光,通常用于检测细胞凋亡和失活细胞。然而,现有的FDA/PI方法只能用于评估成熟花粉的活性,不能用于检测植物早期花粉(小孢子)的活性,因为早期小孢子产生的FDA荧光信号较弱且快速淬灭。
近日,华南农业大学生命科学学院和农学院、亚热带农业生物资源保护与利用国家重点实验室刘耀光院士团队在国际知名学术期刊《Plant Biotechnology Journal》在线发表了题为“An improved fluorescein diacetate–propidium iodide staining system for assessing microspore and pollen viability at different developmental stages”的研究论文,报告了一种改良的FDA/PI荧光染色技术,可应用于鉴定不同发育时期的小孢子或花粉的活性。该改良技术还可以为流式细胞仪分选败育/活性小孢子提供技术支持。

原文链接:
https://onlinelibrary.wiley.com/doi/full/10.1111/pbi.14607
参考已报道的FDA/PI方法,该研究首先使用以H2O调制的FDA/PI荧光染料,但提高了染料浓度(130 μg FDA/mL,87 μg PI /mL),对野生型水稻的四分体小孢子做活性鉴定,发现在激光共聚焦显微镜下活性小孢子发出绿色荧光只能维持最长不超过3 min,随即转变为红色荧光(表示细胞失活,图1A),推测这是由于细胞内外渗透压差异大导致迅速吸水涨破。为了解决细胞活性稳定性问题以便给与足够长的观察和拍照时间,该研究以用于原生质体制备的缓冲液W5替换H2O调制FDA/PI荧光染料(含130 μg FDA/mL和87 μg PI/mL)。以此FDA/PI/W5溶液对水稻四分体小孢子进行活性鉴定,结果发现可以使小孢子产生更强的绿色荧光信号且维持时间超过25分钟(图1A)。
为了验证FDA/PI/W5染色方法鉴定不同发育阶段小孢子和花粉活性的效果和适用性,该研究使用不同败育类型的水稻雄性不育材料进行败育时期的鉴定(同时使用FDA/PI/H2O溶液染色作为对照)。不育材料包括典败型的野败型雄性不育系J23A、典败型籼-粳杂种(F1)雄性不育材料Sa-iSa-j,圆败型亚-非杂种(F1)雄性不育材料Sn-sSn-g,和I2-KI染色F1花粉呈现“全可育类型”的籼-粳杂种不育材料Sd-iSd-j(其F2群体基因型表现为严重偏态分离,即缺乏Sd-jSd-j个体)。结果表明,J23A的花粉败育发生于S12(三核早期)期,S10-S11期的花粉与野生型没有明显差异(图1B);Sa-iSa-j杂种的粳型Sa-j小孢子败育开始于S11阶段,S12阶段基本完全败育(图1B)。在Sn-sSn-g杂种中,成熟期的所有花粉都是具有活性的(能发出绿色荧光),但大约一半的花粉(亚洲稻型Sn-s)的直径比野生型的小,并且这些Sn-s型花粉不能在体外萌发(图1C)。有意思的是,该分析观察到Sd-i/Sd-j杂种的四分体小孢子中有两个发生败育(呈现红色荧光,图1D)。正是因为这些Sd-j基因型小孢子的特早期败育,使它们在后续花粉发育时期中完全降解掉,导致在成熟花粉期表现为“全可育类型”的假象,实际上这些为剩余50%的Sd-i型可育花粉。
值得注意的是,以上遗传材料小孢子和花粉的精确败育时期,都不能通过传统的I2-KI染色方法进行鉴定,也难以用石蜡切片等方法进行鉴定。该改良的FDA/PI/W5染色技术对植物小孢子和花粉的活力和精确败育时期鉴定具有简单有效的特点,更加省时省力和节约成本。
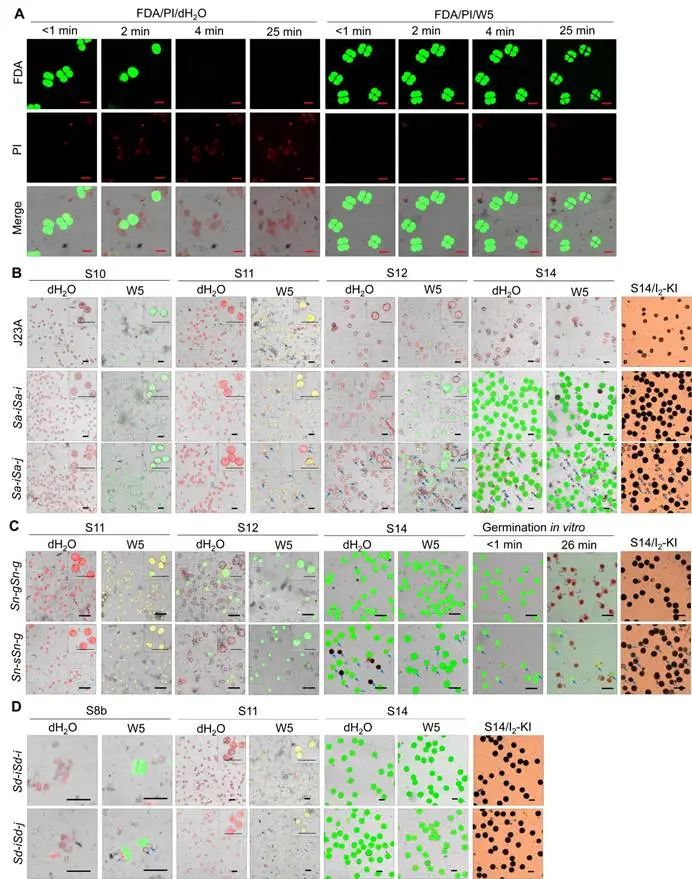
图1改良FDA/PI技术用于鉴定水稻小孢子和花粉的活性
华南农业大学生命科学学院和农学院博士生唐家年、博士后罗琪宇、亚热带农业生物资源保护与利用国家重点实验室李华丽老师为该论文的共同第一作者,农学院刘耀光院士为通讯作者,陈乐天教授对该研究工作给予了指导。该研究得到了国家自然科学基金、广东省基础与应用基础研究基金一般项目和广东省基础与应用基础研究基金重大专项的资助。
References:
Ascari, L., Novara, C., Dusio, V., Oddi, L. and Siniscalco, C. (2020). Quantitative methods in microscopy to assess pollen viability in different plant taxa. Plant Reproduction, 33: 205–219.
Greissl, R. (1989). Vitality analysis of monadic and polyadic pollen grains using optical contrast-fluorescence microscopy. Scientific and Technical Information Processing,9: 180–184.
He, F., Chen, S., Ning, Y. and Wang, G.L. (2016). Rice (Oryza sativa) Protoplast Isolation and Its Application for Transient Expression Analysis. Current protocols in plant biology, 1: 373–383.
Hu, L., Liang, W., Yin, C., Cui, X., Zong, J., Wang, X., Hu, J. et al. (2011). Rice MADS3 regulates ROS homeostasis during late anther development. Plant Cell, 23: 515–533.
Huang, J., Yang, L., Yang, L., Wu, X., Cui, X., Zhang, L., Hui, J. et al. (2023). Stigma receptors control intraspecies and interspecies barriers in Brassicaceae. Nature, 614: 303–308.
Jones, K., Kim, D.W., Park, J.S. and Khang, C.H. (2016). Live-cell fluorescence imaging to investigate the dynamics of plant cell death during infection by the rice blast fungus Magnaporthe oryzae. BMC Plant Biology, 16: 9.
Long, Y., Zhao, L., Niu, B., Su, J., Wu, H., Chen, Y., Zhang, Q. et al. (2008). Hybrid male sterility in rice controlled by interaction between divergent alleles of two adjacent genes. PNAS, 105: 18871–18876.
Riccardi, C. Nicoletti, I. (2006). Analysis of apoptosis by propidium iodide staining and flow cytometry. Nature protocols, 1: 1458–1461.
Rotman, B., Papermaster, B. (1966). Membrane properties of living mammalian cells as studied by enzymatic hydrolysis of fluorogenic esters. PNAS, 55: 134–141.
Xia, S., Li, Y., Jia, X. and Xu C. (1992) Breeding of indicahigh-quality rice sterile line Jin 23A. Hybrid Rice, 7: 29–31.

